POTANSİYEL FARK- GERİLİM
Tüm malzemeler atomlardan oluşur ve tüm atomlar protonlar, nötronlar ve elektronlardan meydana gelir. Protonlar, pozitif elektrik yüküne sahiptir. Nötronların elektrik yükü yoktur (yani Nötrdürler), Elektronlar ise negatif elektrik yüküne sahiptir. Atomlar, atomların çekirdeği ile dış kabuğundaki elektronlar arasında var olan güçlü çekim kuvvetleriyle birbirine bağlanır.
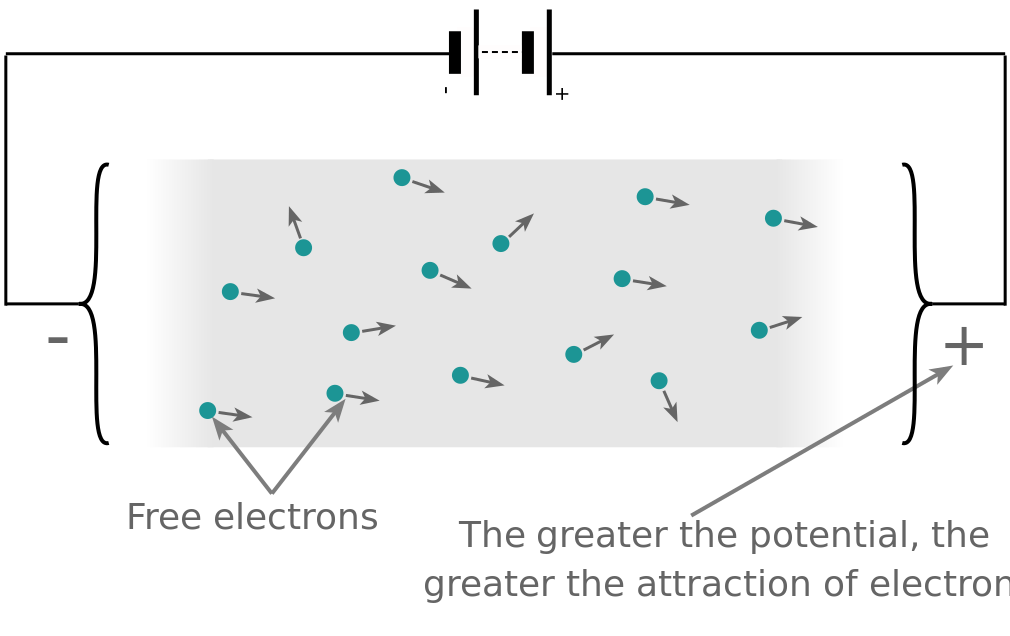
Bu protonlar, nötronlar ve elektronlar atom içinde bir arada olduklarında mutlu ve kararlıdırlar. Ama onları birbirlerinden ayırırsak, değişiklik yapmak isterler ve potansiyel fark denen bir çekim potansiyeli uygulamaya başlarlar.
Şimdi, kapalı bir devre oluşturursak, bu gevşek elektronlar, elektron akışı yaratan çekimlerinden dolayı hareket etmeye ve protonlara geri sürüklenmeye başlayacaklar. Bu elektron akışına elektrik akımı denir. Elektronlar, içinden geçtikleri malzeme elektron akışında bir kısıtlama oluşturduğundan devre boyunca serbestçe akmazlar. Bu kısıtlamaya direnç denir.
Gerilim, (V), elektrik yükü şeklinde depolanan bir elektrik kaynağının potansiyel enerjisidir. Voltaj, elektronları bir iletkenden iten kuvvet olarak düşünülebilir ve voltaj ne kadar büyükse, elektronları belirli bir devre boyunca “itme” yeteneği de o kadar büyük olur. Enerji iş yapma yeteneğine sahip olduğundan, bu potansiyel enerji, elektronları bir devre etrafındaki bir elektrik akımı şeklinde bir noktadan diğerine hareket ettirmek için joule cinsinden yapılan iş olarak tanımlanabilir.
İki nokta arasındaki Potansiyel fark, Volt cinsinden, devre sembolü V veya küçük harf “v” ile ölçülür.
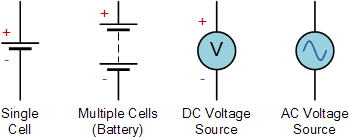
Sabit bir voltaj kaynağına Direct Current- DC. Zamanla periyodik olarak değişen bir voltaja ise Alternative Current AC voltaj denir. Voltaj, volt cinsinden ölçülür, bir volt. 1 Volt; 1 ohmluk dirençten 1 amper elektrik akımı geçirmek için ihtiyaç duyulan potansiyel farktır.
Piller veya güç kaynakları çoğunlukla elektronik devrelerde ve sistemlerde 5v, 12v, 24v gibi sabit bir DC (doğru akım) voltaj kaynağı üretmek için kullanılır. A.C. (alternatif akım) gerilim kaynakları, ev ve endüstriyel güç ve aydınlatmanın yanı sıra güç iletimi için mevcuttur. Birleşik Krallık’taki şebeke voltaj kaynağı şu anda 230 volt a.c.’dir. ve ABD’de 110 volt a.c.
Genel elektronik devreler, 1.5V ile 24V dc arasındaki düşük voltajlı DC pil beslemeleriyle çalışır. Sabit voltaj kaynağı için devre sembolü, genellikle polaritenin yönünü belirten pozitif, + ve negatif, – işaretli bir pil sembolü olarak verilir. Alternatif bir voltaj kaynağı için devre sembolü, içinde bir sinüs dalgası olan bir dairedir.
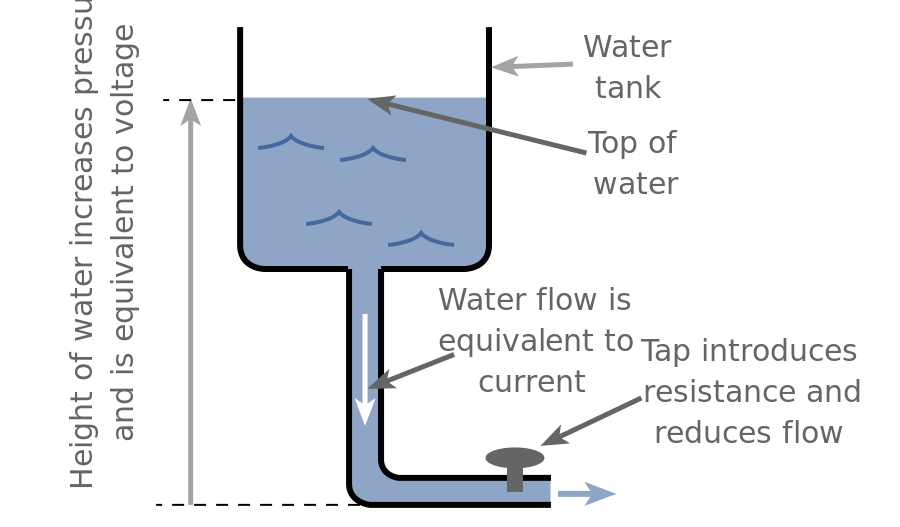
Bir su deposu ile bir voltaj kaynağı arasında basit bir ilişki kurulabilir. Su deposu ne kadar yüksekse, daha fazla enerji açığa çıktıkça suyun basıncı o kadar yüksek olur, voltaj ne kadar yüksek olursa, daha fazla elektron salınırken potansiyel enerji o kadar büyük olur.
Voltaj her zaman bir devredeki herhangi iki nokta arasındaki fark olarak ölçülür ve bu iki nokta arasındaki voltaj genellikle “Potansiyel Fark” olarak adlandırılır. Gerilimin akım olmadan bir devrede var olabileceğini, ancak akımın gerilim olmadan var olamayacağını bilmemiz gerekir. Bu nedenle DC veya AC’nin açık devre durumunu sevmesine rağmen herhangi bir kısa devre durumundan nefret etmesine sebep olur.
- Pil, kimyasal enerjiyi depolayan ve onu elektrik enerjisine dönüştüren bir cihazdır.
- Bir bataryadaki kimyasal reaksiyonlar, elektronların bir elektrottan diğerine harici bir devre yoluyla akışını içerir.
- Elektron akışı, iş yapmak için kullanılabilecek bir elektrik akımı sağlar.
- Elektron akışını dengelemek için yüklü iyonlar ayrıca her iki elektrotla da temas halinde olan bir elektrolit çözeltisinden akar.
- Farklı elektrotlar ve elektrolitler, pilin çalışma şeklini, ne kadar enerji depolayabileceğini ve voltajını etkileyen farklı kimyasal reaksiyonlar üretir.
Pil, kimyasal enerjiyi depolayan ve elektriğe dönüştüren bir cihazdır. Bu elektrokimya olarak bilinir ve bir pilin temelini oluşturan sisteme elektrokimyasal hücre denir. Bir pil, bir veya birkaç elektrokimyasal hücreden (Volta’nın orijinal yığınındaki gibi) oluşabilir. Her bir elektrokimyasal hücre, bir elektrolit ile ayrılmış iki elektrottan oluşur.
Peki bir elektrokimyasal hücre elektriğini nereden alır? Bu soruyu cevaplamak için elektriğin ne olduğunu bilmemiz gerekiyor. En basit haliyle, elektrik, elektron akışı tarafından üretilen bir enerji türüdür. Elektrokimyasal bir hücrede, elektronlar, bir elektrotta meydana gelen kimyasal bir reaksiyonla üretilir (aşağıda elektrotlar hakkında daha fazla bilgi var!) Ve daha sonra kullanıldıkları diğer elektroda akarlar. Bunu doğru bir şekilde anlamak için hücrenin bileşenlerine ve nasıl bir araya getirildiklerine daha yakından bakmamız gerek
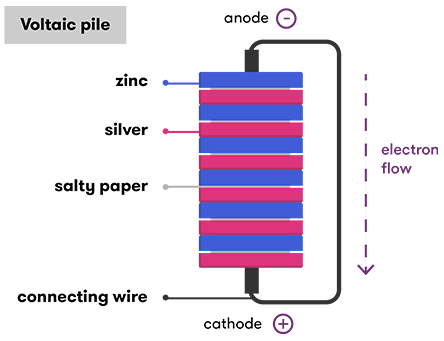
Pilin içinde oluşan kimyasal reaksiyonlar elektron üretmektedir. Elektron üretiminin hızı kimyasal reaksiyonun kontrolündedir. İki uç arasında akan akım pilin iç direnci tarafından kontrol altında tutulmaktadır. Pozitif ve negatif uçlar arasında her hangi bir bağlantı olmaması durumunda kimyasal reaksiyon başlamayacağından pilin ömrünün azalması da söz konusu olmaz.
Alternatif gerilim en basit anlamda manyetik alan içinde hareket eden bir bobinin uçlarında gerilim endüklenmesi olarak ortaya çıkar. Manyetik alan içinde hareket ettirilen bir bobinin uçlarında endüklenen gerilimin dalga biçimi de sinüs dalgasıdır. Dolayısıyla bu kurala bağlı olarak çalışan generatörlerden üretilen alternatif gerilim de sinüsoidaldir.

Yorum gönder